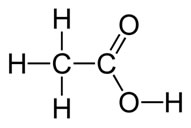
QUESTÃO 1: quantidade de ligações dativas em um determinado ácido. Saber quem é o elemento central; lembrar que o H liga-se primeiro ao O.
QUESTÃO 2: quantidade de ligações dativas em um determinado ácido. Saber quem é o elemento central; lembrar que o H liga-se primeiro ao O.
QUESTÃO 3: quantidade de ligações dativas em um determinado ácido. Saber quem é o elemento central; lembrar que o H liga-se primeiro ao O.
QUESTÃO 4: quantidade de ligações dativas em um determinado ácido. Saber quem é o elemento central; lembrar que o H liga-se primeiro ao O.
QUESTÃO 5: fórmula de bases. Lembrar dos números romanos em Fe Cu Sn Mn Pb Au. Lembrar que OH denomina-se hidroxila.
QUESTÃO 6: reação de neutralização total. Saber a nomenclatura de ácidos (oxiácidos) e bases.
QUESTÃO 7: reação de neutralização total. Saber a nomenclatura de ácidos (oxiácidos) e bases.
QUESTÃO 8: reação de neutralização total. Saber a nomenclatura de ácidos (oxiácidos) e bases.
QUESTÃO 9: reconhecer moléculas com ou sem ligação dativa.
QUESTÃO 10: diferenciar compostos covalentes de iônicos.
QUESTÃO 11: dar o ácido e a base que originaram um determinado sal. Saber nomenclatura de oxiácidos.
QUESTÃO 12: separação de misturas (estudar principalmente: flotação, decantação, destilação, filtração e ventilação)
QUESTÃO 13: subnível mais energético de um elemento.
QUESTÃO 14: ligação iônica. Saber os nomes dos grupos da Tabela Periódica (alcalinos, alcalino-terrosos, calcogênios e halogênios) e suas cargas.
QUESTÃO 15: reconhecer misturas homogêneas e heterogêneas.
BOM ESTUDO! Abraços.
Este blog tem o objetivo de servir como um complemento ao estudo de uma Disciplina que, historicamente, representa a "alma" da humanidade e de tudo o que existe na Natureza: a QUÍMICA. Em especial, dedico aos meus educandos que, de uma maneira geral, estejam interessados em vencer as barreiras tradicionais da Educação. Abrações.
quinta-feira, 28 de novembro de 2013
domingo, 24 de novembro de 2013
Turma 301: dicas para o PROVÃO!!!
"Obstáculos são aquelas coisas medonhas que a gente enxerga, quando desviamos o olhar de nossos objetivos." (Henry Ford).
O que é preciso saber?
O que é preciso saber?
- A prova é composta de 18 questões, sendo 15 obrigatórias;
- Hibridização de carbonos;
- Determinação da fórmula molecular a partir da estrutura;
- Isomeria plana (cadeia, posição, metameria, tautomeria, função), isomeria geométrica (cis e trans), isomeria ótica (carbonos quirais, enantiômeros);
- Reconhecimento de funções orgânicas (álcool, aldeído, ácido carboxílico, amina, amida, cetona, fenol, etc.);
- Reações orgânicas (substituição, adição, eliminação, oxidação);
- 3 questões bônus sobre Bioquímica.
De um modo geral, o(a) aluno(a) deve refazer TODAS os testes e provas realizados durante o ano. BOM ESTUDO!!! Abraços.
Turma 201: dicas para o PROVÃO!!!
"Obstáculos são aquelas coisas medonhas que a gente enxerga, quando desviamos o olhar de nossos objetivos." (Henry Ford).
O que é preciso saber?
O que é preciso saber?
- A prova é composta de 20 questões, sendo 15 obrigatórias;
- 2 questões de cálculo estequiométrico simples;
- 1 questão de soluções (saber a fórmula M = m1/P.V);
- 1 questão de termoquímica (saber teorias sobre reações endo e exotérmicas);
- 6 questões de cinética (interpretação de gráficos, catalisador, energia de ativação, etc.);
- 5 questões de equilíbrio (saber as regras do deslocamento de equilíbrio, pH e pOH).
- 5 questões bônus sobre eletroquímica (pilhas).
De um modo geral, o(a) aluno(a) deve refazer TODAS os testes e provas realizados durante o ano. BOM ESTUDO!!! Abraços.
Turma 101: dicas para o PROVÃO final!!!
"Obstáculos são aquelas coisas medonhas que a gente enxerga, quando desviamos o olhar de nossos objetivos." (Henry Ford).
O que é preciso saber?
O que é preciso saber?
- A prova possui 20 questões, sendo 15 obrigatórias;
- 10 questões de ácidos, bases e sais (neutralização, tipos de sais e tipos de reações, nomenclaturas);
- 1 questão de separação de misturas (destilação simples, destilação fracionada, flotação, filtração, etc.);
- 1 questão de distribuição eletrônica (subnível mais energético);
- 2 questões de ligação iônica (fórmula do composto pela "regra da tesoura"; propriedades dos compostos iônicos);
- 1 questão que engloba ligação covalente dativa e geometria molecular.
- 5 questões bônus sobre tipos de reações químicas (dupla-troca, deslocamento, et.), espontaneidade de reações e balanceamento.
De um modo geral, o aluno deverá refazer TODOS os testes e provas realizados durante o ano. BOM ESTUDO. Abraços.
domingo, 10 de novembro de 2013
Turma 101: TRABALHO do 3º trimestre de 2013
Seres de Luz,
No dia de nossa prova trimestral (13/11) cada aluno(a) deve entregar um trabalho (escrito à mão), de acordo com a seguinte proposta:
Principais ÓXIDOS do cotidiano: onde são encontrados, como são produzidos na natureza, suas principais aplicações, efeitos no organismo humano, suas principais reações.
Não serão aceitos trabalhos digitados em computador, fotocopiados ou digitalizados.
Não esqueça de colocar as fontes de pesquisa (sites, livros, etc).
Não serão aceitas cópias fiéis das fontes de pesquisa (caso dois ou mais alunos tenham as mesmas coisas escritas, os trabalhos de todos esses serão anulados).
RECOMENDA-SE a utilização de livros para confeccionar o trabalho. Isso evitaria cópias, visto que a nossa biblioteca apresenta vastas coleções de livros didáticos.
Após o prazo de entrega nenhum trabalho será recebido.
Abraços.
sexta-feira, 1 de novembro de 2013
9º ano: dicas sobre o teste sobre REAÇÕES DE NEUTRALIZAÇÃO
Nosso teste sobre Reações de Neutralização está constituído de 3 questões, totalizando 10 acertos. Cada acerto valerá 2 pontos, pois o teste vale 20 pontos.
O que saber?
- Equacionar reações de neutralização parcial e total;
- Nomenclatura de ácidos e bases. Cuidar quando temos um hidrácido ou um oxiácido;
- Saber dar as fórmulas do ácido e da base que deram origem ao sal.
- Não esquecer que, independente da ordem em que os reagentes se encontram na equação, a fórmula do sal é formada primeiro pela parte que vem da base e depois pela parte que vem do ácido.
NÃO FOI COLOCADA QUESTÃO BÔNUS NO TESTE. PORTANTO, O ÚLTIMO CONTEÚDO (ESTEQUIOMETRIA) NÃO VAI CAIR!!!
Bom estudo.
domingo, 27 de outubro de 2013
Turma 201: dicas para o teste sobre EQUILÍBRIO QUÍMICO
Pessoas, abaixo estão as dicas para nosso teste do dia 01/11 sobre Equilíbrio Químico:
Obs: o teste será em dupla, mas estas serão escolhidas pelo professor. Caso algum aluno não aceite a sua dupla, poderá fazer sozinho(a) apenas.
QUESTÃO 1: pH: saber calcular a [H+] a partir do pH fornecido.
QUESTÃO 2: pH e pOH: saber relacioná-los, calcular [H+] e [OH-]
QUESTÃO 3: pH: identificar se uma solução é ácida, básica ou neutra a partir de suas [H+]
QUESTÃO 4: Kc: saber calcular a constante de equilíbrio a partir das concentrações fornecidas.
QUESTÃO 5: hidrólise de sais
QUESTÃO 6: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 7: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 8: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 9: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 10: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 11: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 12: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 13: Kp: calcular a constante de equilíbrio a partir das pressões parciais.
QUESTÃO 14: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 15: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 16: pH de uma solução ácida com uma % de ionização.
QUESTÃO 17: pH de uma solução básica com uma % de dissociação.
QUESTÃO 18: cálculo de [H+] a partir do pOH.
QUESTÃO 19: cálculo de pH a partir da massa de ácido em solução aquosa. Lembrar da fórmula M = (m1/P.V)
QUESTÃO 20: hidrólise de sais (previsão do pH de soluções aquosas de sais).
ASSISTA AOS VÍDEOS:
ÓTIMO ESTUDO!!!
Obs: o teste será em dupla, mas estas serão escolhidas pelo professor. Caso algum aluno não aceite a sua dupla, poderá fazer sozinho(a) apenas.
QUESTÃO 1: pH: saber calcular a [H+] a partir do pH fornecido.
QUESTÃO 2: pH e pOH: saber relacioná-los, calcular [H+] e [OH-]
QUESTÃO 3: pH: identificar se uma solução é ácida, básica ou neutra a partir de suas [H+]
QUESTÃO 4: Kc: saber calcular a constante de equilíbrio a partir das concentrações fornecidas.
QUESTÃO 5: hidrólise de sais
QUESTÃO 6: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 7: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 8: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 9: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 10: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 11: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 12: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 13: Kp: calcular a constante de equilíbrio a partir das pressões parciais.
QUESTÃO 14: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 15: deslocamento de equilíbrio (influência da concentração, temperatura e pressão).
QUESTÃO 16: pH de uma solução ácida com uma % de ionização.
QUESTÃO 17: pH de uma solução básica com uma % de dissociação.
QUESTÃO 18: cálculo de [H+] a partir do pOH.
QUESTÃO 19: cálculo de pH a partir da massa de ácido em solução aquosa. Lembrar da fórmula M = (m1/P.V)
QUESTÃO 20: hidrólise de sais (previsão do pH de soluções aquosas de sais).
ASSISTA AOS VÍDEOS:
ÓTIMO ESTUDO!!!
domingo, 20 de outubro de 2013
Turma 101: Dicas para o teste sobre SAIS INORGÂNICOS.
Nosso teste, marcado para o dia 25/10 (sexta-feira), está constituído de 20 questões (valor total = 10,0).
A estrutura de nossa avaliação é a seguinte:
QUESTÃO 1: interpretação de texto. O aluno deverá ler atentamente o parágrafo inicial e responder a questão de acordo com seus conhecimentos gerais sobre um tipo de sal muito comum em nosso dia-a-dia.
QUESTÃO 2: reconhecimento de funções. São dados os nomes de alguns produtos comerciais do nosso cotidiano, e pede-se o tipo de função presente neles. Por exemplo: a soda caústica é formada de hidróxido de sódio, que é uma base.
QUESTÃO 3: nomenclatura de sais. O aluno poderá consultar a tabela de cátions e ânions para fornecer a fórmula dos sais pedidos. Cuidar a regra da tesoura.
QUESTÃO 4: nomenclatura de sais e tipo de reação de neutralização. Por exemplo: o sulfato de cobre II (ou sulfato cúprico) possui fórmula CuSO4, e é classificado como um sal neutro de reação ácida, pois é originado através da neutralização total entre Cu(OH)2 (base fraca) e H2SO4 (ácido forte).
QUESTÃO 5: reação de neutralização (e seus tipos). Por exemplo: o bicarbonato de lítio, cuja fórmula é LiHCO3, é classificado como um sal ácido de reação básica, pois é obtido através da neutralização parcial entre LiOH (base forte) e H2CO3 (ácido fraco). Logo, o bicarbonato de lítio é um sal com propriedades básicas (= caráter básico) e pode combater, por exemplo, a acidez estomacal. Não esquecer: sal de reação básica pode combater ácidos; sal de reação ácida pode combater bases. COMBATER = NEUTRALIZAR.
QUESTÃO 6: nomenclatura de sais e suas propriedades. Lembrar que a maioria dos sais são compostos iônicos e que, portanto, só conduzem eletricidade quando fundidos ou em solução aquosa.
QUESTÃO 7: nomenclatura de sais. Consultar tabela de cátions e ânions. Cuidar a regra da tesoura.
QUESTÃO 8: nomenclatura de sais. Consultar tabela de cátions e ânions. Cuidar a regra da tesoura.
QUESTÃO 9: nomenclatura de sais. Consultar tabela de cátions e ânions. Cuidar a regra da tesoura.
QUESTÃO 10: nomenclatura de sais e suas propriedades; número de oxidação; tipo de reação de neutralização.
QUESTÃO 11: solubilidade de sais. O aluno poderá consultar a tabela de solubilidade de sais. Observação: precipitado é um sólido insolúvel em água, formado em uma reação. Por exemplo: a reação entre nitrato plumboso [Pb(NO3)2]e ácido clorídrico (HCl) produz o sal cloreto plumboso (PbCl2)e ácido nítrico (HNO3), conforme a seguinte reação:
Pb(NO3)2 + 2HCl à PbCl2 + 2HNO3.
O sal cloreto plumboso é insolúvel em água. Logo, ele é um precipitado formado na reação.
QUESTÃO 12: fórmula química de sais. Lembrar os nomes dos principais grupos da tabela periódica (alcalinos, halogênios, etc.) e suas respectivas cargas (números de oxidação). Por exemplo: Qual é a fórmula resultante da união entre um metal alcalino (A) e um calcogênio (B)? Resposta: A2B.
QUESTÃO 13: solubilidade de sais. Lembrar que precipitado é um sólido insolúvel em água. Por exemplo: de acordo com a tabela de solubilidade de sais, o cloreto de sódio (NaCl) é solúvel e o cloreto de prata (AgCl) é insolúvel em água. Logo, se ambos os sais citados forem adicionados à água, o cloreto de prata não vai se dissolver. Se fizéssemos uma filtração dessa mistura, o cloreto de prata ficaria no filtro e o cloreto de sódio passaria junto com a água.
QUESTÃO 14: reação de neutralização. Lembrar que hidrogênio ionizável é aquele hidrogênio do ácido ligado ao oxigênio. Por exemplo: observe a molécula abaixo, do ácido etanoico (H4C2O2)
Quantos hidrogênios ionizáveis ela tem? Apenas um!
Lembrar também que apenas os hidrogênios ionizáveis do ácido podem se juntar com as hidroxilas (OH) da base para formar a água, em reações de neutralização. Exemplos:
QUESTÃO 15: fórmula química de sais obtidos em reação de neutralização (tomar como exemplo os dois sais obtidos nas reações da questão anterior: 1CaOH(H3C2O2) e 1Ca(H3C2O2)2
QUESTÃO 16: nomenclatura de sais. Lembrar algumas nomenclaturas dadas pelo professor, que não estão nas tabelas. Por exemplo: ânion bissulfato (HSO4-1) = ânion hidrogenossulfato.
QUESTÃO 17: nomenclatura de sais hidratados (conteúdo inicial de sais, dado pelo professor e copiado no caderno). Exemplo: Na2CO3 . 10H2O = carbonato de sódio decahidratado.
QUESTÃO 18: reação de neutralização.
QUESTÃO 19: fórmula química de sais, a partir de seus cátions e ânions (regra da tesoura)
QUESTÃO 20: nomenclatura de ácidos, bases, sais e óxidos. O aluno não precisa se preocupar com nomenclatura de óxidos, pois a questão pode ser perfeitamente realizada por eliminação de alternativas falsas.
Atenção! O teste será em dupla. No entanto, a escolha das duplas será realizada pelo professor. NÃO ADIANTA INSISTIR. Caso algum aluno não aceite o(a) seu(sua) companheiro(a) da dupla, obterá nota ZERO (no teste e no qualitativo). Caso um dos componentes da dupla não compareça na aula, o(a) outro(a) componente fará o teste SOZINHO(A). Como a turma está composta de 37 alunos, haverá apenas um grupo formado de três pessoas (escolhido pelo professor).
BOM ESTUDO!
A estrutura de nossa avaliação é a seguinte:
QUESTÃO 1: interpretação de texto. O aluno deverá ler atentamente o parágrafo inicial e responder a questão de acordo com seus conhecimentos gerais sobre um tipo de sal muito comum em nosso dia-a-dia.
QUESTÃO 2: reconhecimento de funções. São dados os nomes de alguns produtos comerciais do nosso cotidiano, e pede-se o tipo de função presente neles. Por exemplo: a soda caústica é formada de hidróxido de sódio, que é uma base.
QUESTÃO 3: nomenclatura de sais. O aluno poderá consultar a tabela de cátions e ânions para fornecer a fórmula dos sais pedidos. Cuidar a regra da tesoura.
QUESTÃO 4: nomenclatura de sais e tipo de reação de neutralização. Por exemplo: o sulfato de cobre II (ou sulfato cúprico) possui fórmula CuSO4, e é classificado como um sal neutro de reação ácida, pois é originado através da neutralização total entre Cu(OH)2 (base fraca) e H2SO4 (ácido forte).
QUESTÃO 5: reação de neutralização (e seus tipos). Por exemplo: o bicarbonato de lítio, cuja fórmula é LiHCO3, é classificado como um sal ácido de reação básica, pois é obtido através da neutralização parcial entre LiOH (base forte) e H2CO3 (ácido fraco). Logo, o bicarbonato de lítio é um sal com propriedades básicas (= caráter básico) e pode combater, por exemplo, a acidez estomacal. Não esquecer: sal de reação básica pode combater ácidos; sal de reação ácida pode combater bases. COMBATER = NEUTRALIZAR.
QUESTÃO 6: nomenclatura de sais e suas propriedades. Lembrar que a maioria dos sais são compostos iônicos e que, portanto, só conduzem eletricidade quando fundidos ou em solução aquosa.
QUESTÃO 7: nomenclatura de sais. Consultar tabela de cátions e ânions. Cuidar a regra da tesoura.
QUESTÃO 8: nomenclatura de sais. Consultar tabela de cátions e ânions. Cuidar a regra da tesoura.
QUESTÃO 9: nomenclatura de sais. Consultar tabela de cátions e ânions. Cuidar a regra da tesoura.
QUESTÃO 10: nomenclatura de sais e suas propriedades; número de oxidação; tipo de reação de neutralização.
QUESTÃO 11: solubilidade de sais. O aluno poderá consultar a tabela de solubilidade de sais. Observação: precipitado é um sólido insolúvel em água, formado em uma reação. Por exemplo: a reação entre nitrato plumboso [Pb(NO3)2]e ácido clorídrico (HCl) produz o sal cloreto plumboso (PbCl2)e ácido nítrico (HNO3), conforme a seguinte reação:
Pb(NO3)2 + 2HCl à PbCl2 + 2HNO3.
O sal cloreto plumboso é insolúvel em água. Logo, ele é um precipitado formado na reação.
QUESTÃO 12: fórmula química de sais. Lembrar os nomes dos principais grupos da tabela periódica (alcalinos, halogênios, etc.) e suas respectivas cargas (números de oxidação). Por exemplo: Qual é a fórmula resultante da união entre um metal alcalino (A) e um calcogênio (B)? Resposta: A2B.
QUESTÃO 13: solubilidade de sais. Lembrar que precipitado é um sólido insolúvel em água. Por exemplo: de acordo com a tabela de solubilidade de sais, o cloreto de sódio (NaCl) é solúvel e o cloreto de prata (AgCl) é insolúvel em água. Logo, se ambos os sais citados forem adicionados à água, o cloreto de prata não vai se dissolver. Se fizéssemos uma filtração dessa mistura, o cloreto de prata ficaria no filtro e o cloreto de sódio passaria junto com a água.
QUESTÃO 14: reação de neutralização. Lembrar que hidrogênio ionizável é aquele hidrogênio do ácido ligado ao oxigênio. Por exemplo: observe a molécula abaixo, do ácido etanoico (H4C2O2)
Quantos hidrogênios ionizáveis ela tem? Apenas um!
Lembrar também que apenas os hidrogênios ionizáveis do ácido podem se juntar com as hidroxilas (OH) da base para formar a água, em reações de neutralização. Exemplos:
- Neutralização parcial com Ca(OH)2: 1Ca(OH)2 + 1H4C2O2 à 1CaOH(H3C2O2) + 1H2O
- Neutralização total com Ca(OH)2: 1Ca(OH)2 + 2H4C2O2 à 1Ca(H3C2O2)2 + 2H2O
QUESTÃO 15: fórmula química de sais obtidos em reação de neutralização (tomar como exemplo os dois sais obtidos nas reações da questão anterior: 1CaOH(H3C2O2) e 1Ca(H3C2O2)2
QUESTÃO 16: nomenclatura de sais. Lembrar algumas nomenclaturas dadas pelo professor, que não estão nas tabelas. Por exemplo: ânion bissulfato (HSO4-1) = ânion hidrogenossulfato.
QUESTÃO 17: nomenclatura de sais hidratados (conteúdo inicial de sais, dado pelo professor e copiado no caderno). Exemplo: Na2CO3 . 10H2O = carbonato de sódio decahidratado.
QUESTÃO 18: reação de neutralização.
QUESTÃO 19: fórmula química de sais, a partir de seus cátions e ânions (regra da tesoura)
QUESTÃO 20: nomenclatura de ácidos, bases, sais e óxidos. O aluno não precisa se preocupar com nomenclatura de óxidos, pois a questão pode ser perfeitamente realizada por eliminação de alternativas falsas.
Atenção! O teste será em dupla. No entanto, a escolha das duplas será realizada pelo professor. NÃO ADIANTA INSISTIR. Caso algum aluno não aceite o(a) seu(sua) companheiro(a) da dupla, obterá nota ZERO (no teste e no qualitativo). Caso um dos componentes da dupla não compareça na aula, o(a) outro(a) componente fará o teste SOZINHO(A). Como a turma está composta de 37 alunos, haverá apenas um grupo formado de três pessoas (escolhido pelo professor).
BOM ESTUDO!
quarta-feira, 2 de outubro de 2013
Turma 101: Dicas para o teste do dia 04/10
BOM ESTUDO! ABRAÇOS.
Número de Oxidação:
Ácidos e Bases de Arrhenius (assistir até o tempo de 10 min 44s):
Estudar os slides e a última lista corrigida em aula!
quarta-feira, 18 de setembro de 2013
domingo, 1 de setembro de 2013
Turmas 91 e 92: dicas para a prova trimestral do dia 04/09
Dentre os diversos conhecimentos adquiridos em nossas aulas, deve-se destacar:
- Distribuição eletrônica de átomos neutros e íons.
- Saber o que é subnível mais energético e como localizar um elemento na Tabela Periódica a partir dele.
- Lembrar as definições de cátion (monovalente, divalente, trivalente, etc.) e ânion (monovalente, divalente, trivalente, etc.).
- Nomes dos principais grupos: alcalinos, alcalino-terrosos, calcogênio, halogênios e gases nobres.
- Ligações Químicas:
- Ligação Iônica: saber construir as fórmulas iônica e do composto.
- Ligação Covalente: saber construir as fórmulas molecular e estrutural
- Saber diferenciar os dois tipos de ligação através de suas classificações na tabela periódica (metais e não-metais).
- Saber o que é a REGRA DO OCTETO e quais as suas exceções.
A prova possui 12 questões e uma questão bônus. Os alunos poderão optar pelo seu valor (40,0 ou 60,0). A opção deverá ser feita no momento da entrega da prova pelo aluno. Abraços.
ALGUNS VÍDEOS PARA AUXILIAR NA APRENDIZAGEM:
DESCONSIDERAR LIGAÇÃO METÁLICA, NO ÚLTIMO VÍDEO.
domingo, 23 de junho de 2013
Turmas 91 e 92: dicas para TESTE
Estudar os vídeos:
Estrutura Atômica:
Distribuição Eletrônica:
ABRAÇOS.
sexta-feira, 14 de junho de 2013
quinta-feira, 13 de junho de 2013
domingo, 19 de maio de 2013
Turma 101: Lista de Exercícios sobre PROPRIEDADES PERIÓDICAS
Imprimir e trazer para a aula: clica aqui. NÃO PRECISA DE SENHA. Abrações.
domingo, 5 de maio de 2013
Turma 301: TRABALHO Avaliativo de Química!!!
Pode ser realizado INDIVIDUAL ou em DUPLA (não serão aceitos trabalhos com mais de duas pessoas)
DATA DE ENTREGA: 10/05. Entregar um trabalho por dupla, legivelmente escrito à mão ou digitado.
NÃO SERÃO ACEITOS TRABALHOS APÓS ESTA DATA.
O QUE FAZER: cada dupla deverá recortar e colar no trabalho rótulos de duas marcas diferentes de produtos alimentícios ou de limpeza, que contenham moléculas orgânicas em sua composição. Faça o que se pede:
1. para cada rótulo, escolher um composto orgânico e pesquisar quais são as suas fórmulas estruturais (anexar/colar em forma de figuras as estruturas pesquisadas).
2. Fornecer as fórmulas moleculares dos compostos escolhidos.
3. Classificar as cadeias carbônicas de cada composto (normal, ramificada, saturada, etc.)
4. Quantificar os carbonos sp, sp² e sp³ de cada composto.
5. Nas figuras da questão 1, destacar e fornecer as funções orgânicas presentes em cada composto.
6. Pesquisar os efeitos fisiológicos (benéficos ou não) ocasionados por esses compostos no organismo humano (toxicidade, efeitos colaterais, etc.).
NÃO esquecer de fornecer as fontes de todas as informações extras (sites, livros, revistas, etc.).
DATA DE ENTREGA: 10/05. Entregar um trabalho por dupla, legivelmente escrito à mão ou digitado.
NÃO SERÃO ACEITOS TRABALHOS APÓS ESTA DATA.
O QUE FAZER: cada dupla deverá recortar e colar no trabalho rótulos de duas marcas diferentes de produtos alimentícios ou de limpeza, que contenham moléculas orgânicas em sua composição. Faça o que se pede:
1. para cada rótulo, escolher um composto orgânico e pesquisar quais são as suas fórmulas estruturais (anexar/colar em forma de figuras as estruturas pesquisadas).
2. Fornecer as fórmulas moleculares dos compostos escolhidos.
3. Classificar as cadeias carbônicas de cada composto (normal, ramificada, saturada, etc.)
4. Quantificar os carbonos sp, sp² e sp³ de cada composto.
5. Nas figuras da questão 1, destacar e fornecer as funções orgânicas presentes em cada composto.
6. Pesquisar os efeitos fisiológicos (benéficos ou não) ocasionados por esses compostos no organismo humano (toxicidade, efeitos colaterais, etc.).
NÃO esquecer de fornecer as fontes de todas as informações extras (sites, livros, revistas, etc.).
Turma 201: TRABALHO Avaliativo de Química!!!
Pode ser realizado INDIVIDUAL ou em DUPLA (não serão aceitos trabalhos com mais de duas pessoas)
DATA DE ENTREGA: 10/05. Entregar um trabalho por dupla, legivelmente escrito à mão ou digitado.
NÃO SERÃO ACEITOS TRABALHOS APÓS ESTA DATA.
O QUE FAZER: cada dupla deverá recortar e colar no trabalho um rótulo de uma marca de água mineral, e responder às seguintes questões:
1. Pesquise quais são as fórmulas químicas de TODOS os íons (cátions e ânions) presentes na composição química da água mineral que você escolheu? (sulfato, carbonato, bicarbonato, cloreto, fluoreto, vanádio, etc.).
2. Escolha um ânion oxigenado da composição química, e forneça:
a) quantos gramas deste ânion existe no volume de água da garrafa que você escolheu? Dica: a composição química das águas minerais fornece a quantidade, em miligramas, de cada componente presente em um litro. É só fazer uma regra de três simples.
b) quantos íons (do que você escolheu) estão presentes na garrafa. Dica: após ter calculado a massa total deste íons escolhido na alternativa "a", e após ter calculado a massa molar do mesmo (tabela periódica), faça uma regra de três simples utilizando o número de Avogadro (602 sextilhões).
c) quantos átomos de oxigênio (do ânion escolhido) estão presentes em todo o volume de água mineral da garrafa.
3. Pesquise o significado de pH, e cite quais são as consequências fisiológicas (ação no corpo humano) que o valor de pH da água mineral escolhida pode acarretar no organismo.
Turma 101: TRABALHO Avaliativo de Química!!!
Pode ser realizado INDIVIDUAL ou em DUPLA (não serão aceitos trabalhos com mais de duas pessoas)
DATA DE ENTREGA: 10/05. Entregar um trabalho por dupla, legivelmente escrito à mão ou digitado.
NÃO SERÃO ACEITOS TRABALHOS APÓS ESTA DATA.
O QUE FAZER: cada dupla deverá recortar e colar no trabalho rótulos de duas marcas diferentes de água mineral, e responder às seguintes questões:
1. Pesquise quais são as fórmulas químicas de TODOS os íons (cátions e ânions) presentes na composição química da água mineral que você escolheu? (sulfato, carbonato, bicarbonato, cloreto, fluoreto, vanádio, etc.)
2. Dê o número total de partículas fundamentais de cada ânion presente na composição.
3. Faça a configuração eletrônica de cada cátion presente na composição.
4. Escolha uma espécie química da questão anterior para fornecer os números quânticos de todos os seus elétrons. Pesquise o que são elétrons celibatários, e indique a presença ou não dele na espécie que você escolheu.
DATA DE ENTREGA: 10/05. Entregar um trabalho por dupla, legivelmente escrito à mão ou digitado.
NÃO SERÃO ACEITOS TRABALHOS APÓS ESTA DATA.
O QUE FAZER: cada dupla deverá recortar e colar no trabalho rótulos de duas marcas diferentes de água mineral, e responder às seguintes questões:
1. Pesquise quais são as fórmulas químicas de TODOS os íons (cátions e ânions) presentes na composição química da água mineral que você escolheu? (sulfato, carbonato, bicarbonato, cloreto, fluoreto, vanádio, etc.)
2. Dê o número total de partículas fundamentais de cada ânion presente na composição.
3. Faça a configuração eletrônica de cada cátion presente na composição.
4. Escolha uma espécie química da questão anterior para fornecer os números quânticos de todos os seus elétrons. Pesquise o que são elétrons celibatários, e indique a presença ou não dele na espécie que você escolheu.
Turmas 91 e 92: TRABALHO Avaliativo de Química!!!
Pode ser realizado INDIVIDUAL ou em DUPLA (não serão aceitos trabalhos com mais de duas pessoas)
DATA DE ENTREGA: 09/05 (no caso da turma 91, em que só temos aula nas quartas-feiras, o líder da turma ficará de responsável para entregar TODOS os trabalhos para mim, na sala dos professores). Entregar um trabalho por dupla, legivelmente escrito à mão ou digitado.
NÃO SERÃO ACEITOS TRABALHOS APÓS ESTA DATA.
1. Quem foi o cientista criador da famosa frase “Nada se cria, nada se perde, tudo se transforma”, estampada na primeira página do texto? O que esse cientista quis dizer com isso?
2. Qual a relação entre as refinarias de petróleo e a produção agrícola necessária para alimentar a
humanidade?
3. Por que a fabricação do açúcar de cana (sacarose) obriga, automaticamente, à produção de etanol
(álcool etílico)? Faça uma pesquisa extra sobre a(s) substância(s) química(s) presente(s) nos resíduos da
produção de açúcar (reações químicas, alternativas de descarte, etc.).
4. O que é e como se produz o combustível de lixo?
5.
a) Qual a substância constituinte das garrafas PET? Pesquise e cole junto à sua resposta o desenho da
molécula (estrutura molecular) dessa substância.
b) Qual o principal motivo da poluição ambiental causada pelo PET, e que alternativa você, estudante,
daria para combatê-la?
6. O autor concluiu o texto com uma opinião daquilo que ele achou ser a “receita da sustentabilidade”. Em
sua opinião, quais seriam as principais dicas para se promover a sustentabilidade ambiental, começando
pela sua casa?
7. Qual é o processo de separação de misturas utilizado para obter os componentes do petróleo? Explique-o através de figura (pesquise na internet ou recorte de revistas).
DATA DE ENTREGA: 09/05 (no caso da turma 91, em que só temos aula nas quartas-feiras, o líder da turma ficará de responsável para entregar TODOS os trabalhos para mim, na sala dos professores). Entregar um trabalho por dupla, legivelmente escrito à mão ou digitado.
NÃO SERÃO ACEITOS TRABALHOS APÓS ESTA DATA.
Tendo como base principal de informação o texto RECEITA DA SUSTENTABILIDADE, de Fernando Galembeck, extraído da revista Ciência Hoje (volume 47 / 2011), responda às questões abaixo, com o máximo de objetividade e clareza possível.
QUALQUER INFORMAÇÃO QUE NÃO SEJA RETIRADA DO TEXTO DEVE VIR ACOMPANHADA DA FONTE DA QUAL FOI EXTRAÍDA (SITES, REVISTAS, LIVROS, ETC.)!
Clique aqui para baixar o texto.
QUESTÕES:
2. Qual a relação entre as refinarias de petróleo e a produção agrícola necessária para alimentar a
humanidade?
3. Por que a fabricação do açúcar de cana (sacarose) obriga, automaticamente, à produção de etanol
(álcool etílico)? Faça uma pesquisa extra sobre a(s) substância(s) química(s) presente(s) nos resíduos da
produção de açúcar (reações químicas, alternativas de descarte, etc.).
4. O que é e como se produz o combustível de lixo?
5.
a) Qual a substância constituinte das garrafas PET? Pesquise e cole junto à sua resposta o desenho da
molécula (estrutura molecular) dessa substância.
b) Qual o principal motivo da poluição ambiental causada pelo PET, e que alternativa você, estudante,
daria para combatê-la?
6. O autor concluiu o texto com uma opinião daquilo que ele achou ser a “receita da sustentabilidade”. Em
sua opinião, quais seriam as principais dicas para se promover a sustentabilidade ambiental, começando
pela sua casa?
7. Qual é o processo de separação de misturas utilizado para obter os componentes do petróleo? Explique-o através de figura (pesquise na internet ou recorte de revistas).
domingo, 7 de abril de 2013
Turma 301: DICAS para o teste
Pessoas iluminadas, o nosso teste consta de 20 questões. Não coloquei nomenclatura de hidrocarbonetos. Não se esqueçam de colar os cartazes das funções.
Abaixo, mais alguns complementos aos vossos estudos:
ABRAÇÕES!!!
Abaixo, mais alguns complementos aos vossos estudos:
ABRAÇÕES!!!
domingo, 31 de março de 2013
Turma 201: DICAS para o teste
Alguns vídeos para complementar o teu estudo. Abrações!!!
DESCONSIDERAR QUALQUER INFORMAÇÃO NOS VÍDEOS QUE AINDA NÃO TENHA SIDO EXPLICADA EM AULA, OU QUE TENHA SIDO EXPLICADA DE OUTRA FORMA.
Turmas 91 e 92: DICAS para o teste.
O teste será sem consulta e individual. Estudar, principalmente, os seguintes itens:
- Sistemas Materiais (substância pura e mistura);
- Estados físicos da matéria e suas transformações;
- Fenômenos físicos e químicos;
- Densidade (saber calcular o volume de um objeto tridimensional)
- Transformações de unidades relativas (exemplo: de Kg/m³ para g/cm³).
Assista ao vídeo para complementar o seu estudo. Abrações!!!
DESCONSIDERAR, NO VÍDEO, OS GRÁFICOS E OUTRAS INFORMAÇÕES QUE NÃO TENHAM SIDO VISTAS EM AULA!!!
domingo, 10 de março de 2013
1º ANO: Exercícios Complementares
Clique aqui.
Gabarito:
1.D
2.D
3.E
4.C
5.B
6.E
7.D
8.C
9.A
10.E
11.E
12.C
13.A
14.C
15.D
domingo, 3 de março de 2013
Turma 101: Exercícios complementares
Clique aqui para baixar a nossa primeira lista de exercícios. Não esqueça da senha fornecida em aula. Abraços.
domingo, 24 de fevereiro de 2013
Turmas 91 e 92: Exercícios de revisão
Esta lista de exercícios deverá estar com o(a) aluno(a) em aula, e deverá ser realizada como tarefa:
Clica aqui (Não esqueça que é necessário uma senha, que já foi fornecida pelo professor)
terça-feira, 19 de fevereiro de 2013
2013: Mensagem de volta às aulas.
DESEJO QUE VOCÊ
Não tenha medo da vida, tenha medo de não vivê-la.
Não há céus sem tempestades, nem caminhos sem acidentes.
Só é digno do pódio quem usa as derrotas para alcançá-lo.
Só é digno da sabedoria quem usa as lágrimas para irrigá-la.
Os frágeis usam a força; os fortes, a inteligência.
Seja um sonhador, mas una seus sonhos com disciplina, pois sonhos sem disciplina produzem pessoas frustradas.
Seja um debatedor de ideias. Lute pelo que você ama.
(FILHOS BRILHANTES, ALUNOS FASCINANTES. Augusto Cury)
VAMOS TRILHAR UM CAMINHO JUNTOS, DE COMPANHEIRISMO, COMPREENSÃO E DE MUITO SUCESSO. ABRAÇÕES AOS MEUS QUERIDOS EDUCANDOS DE 2013!
Assinar:
Postagens (Atom)