A estrutura de nossa avaliação é a seguinte:
QUESTÃO 1: interpretação de texto. O aluno deverá ler atentamente o parágrafo inicial e responder a questão de acordo com seus conhecimentos gerais sobre um tipo de sal muito comum em nosso dia-a-dia.
QUESTÃO 2: reconhecimento de funções. São dados os nomes de alguns produtos comerciais do nosso cotidiano, e pede-se o tipo de função presente neles. Por exemplo: a soda caústica é formada de hidróxido de sódio, que é uma base.
QUESTÃO 3: nomenclatura de sais. O aluno poderá consultar a tabela de cátions e ânions para fornecer a fórmula dos sais pedidos. Cuidar a regra da tesoura.
QUESTÃO 4: nomenclatura de sais e tipo de reação de neutralização. Por exemplo: o sulfato de cobre II (ou sulfato cúprico) possui fórmula CuSO4, e é classificado como um sal neutro de reação ácida, pois é originado através da neutralização total entre Cu(OH)2 (base fraca) e H2SO4 (ácido forte).
QUESTÃO 5: reação de neutralização (e seus tipos). Por exemplo: o bicarbonato de lítio, cuja fórmula é LiHCO3, é classificado como um sal ácido de reação básica, pois é obtido através da neutralização parcial entre LiOH (base forte) e H2CO3 (ácido fraco). Logo, o bicarbonato de lítio é um sal com propriedades básicas (= caráter básico) e pode combater, por exemplo, a acidez estomacal. Não esquecer: sal de reação básica pode combater ácidos; sal de reação ácida pode combater bases. COMBATER = NEUTRALIZAR.
QUESTÃO 6: nomenclatura de sais e suas propriedades. Lembrar que a maioria dos sais são compostos iônicos e que, portanto, só conduzem eletricidade quando fundidos ou em solução aquosa.
QUESTÃO 7: nomenclatura de sais. Consultar tabela de cátions e ânions. Cuidar a regra da tesoura.
QUESTÃO 8: nomenclatura de sais. Consultar tabela de cátions e ânions. Cuidar a regra da tesoura.
QUESTÃO 9: nomenclatura de sais. Consultar tabela de cátions e ânions. Cuidar a regra da tesoura.
QUESTÃO 10: nomenclatura de sais e suas propriedades; número de oxidação; tipo de reação de neutralização.
QUESTÃO 11: solubilidade de sais. O aluno poderá consultar a tabela de solubilidade de sais. Observação: precipitado é um sólido insolúvel em água, formado em uma reação. Por exemplo: a reação entre nitrato plumboso [Pb(NO3)2]e ácido clorídrico (HCl) produz o sal cloreto plumboso (PbCl2)e ácido nítrico (HNO3), conforme a seguinte reação:
Pb(NO3)2 + 2HCl à PbCl2 + 2HNO3.
O sal cloreto plumboso é insolúvel em água. Logo, ele é um precipitado formado na reação.
QUESTÃO 12: fórmula química de sais. Lembrar os nomes dos principais grupos da tabela periódica (alcalinos, halogênios, etc.) e suas respectivas cargas (números de oxidação). Por exemplo: Qual é a fórmula resultante da união entre um metal alcalino (A) e um calcogênio (B)? Resposta: A2B.
QUESTÃO 13: solubilidade de sais. Lembrar que precipitado é um sólido insolúvel em água. Por exemplo: de acordo com a tabela de solubilidade de sais, o cloreto de sódio (NaCl) é solúvel e o cloreto de prata (AgCl) é insolúvel em água. Logo, se ambos os sais citados forem adicionados à água, o cloreto de prata não vai se dissolver. Se fizéssemos uma filtração dessa mistura, o cloreto de prata ficaria no filtro e o cloreto de sódio passaria junto com a água.
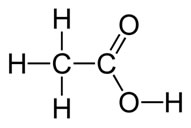
QUESTÃO 14: reação de neutralização. Lembrar que hidrogênio ionizável é aquele hidrogênio do ácido ligado ao oxigênio. Por exemplo: observe a molécula abaixo, do ácido etanoico (H4C2O2)
Quantos hidrogênios ionizáveis ela tem? Apenas um!
Lembrar também que apenas os hidrogênios ionizáveis do ácido podem se juntar com as hidroxilas (OH) da base para formar a água, em reações de neutralização. Exemplos:
- Neutralização parcial com Ca(OH)2: 1Ca(OH)2 + 1H4C2O2 à 1CaOH(H3C2O2) + 1H2O
- Neutralização total com Ca(OH)2: 1Ca(OH)2 + 2H4C2O2 à 1Ca(H3C2O2)2 + 2H2O
QUESTÃO 15: fórmula química de sais obtidos em reação de neutralização (tomar como exemplo os dois sais obtidos nas reações da questão anterior: 1CaOH(H3C2O2) e 1Ca(H3C2O2)2
QUESTÃO 16: nomenclatura de sais. Lembrar algumas nomenclaturas dadas pelo professor, que não estão nas tabelas. Por exemplo: ânion bissulfato (HSO4-1) = ânion hidrogenossulfato.
QUESTÃO 17: nomenclatura de sais hidratados (conteúdo inicial de sais, dado pelo professor e copiado no caderno). Exemplo: Na2CO3 . 10H2O = carbonato de sódio decahidratado.
QUESTÃO 18: reação de neutralização.
QUESTÃO 19: fórmula química de sais, a partir de seus cátions e ânions (regra da tesoura)
QUESTÃO 20: nomenclatura de ácidos, bases, sais e óxidos. O aluno não precisa se preocupar com nomenclatura de óxidos, pois a questão pode ser perfeitamente realizada por eliminação de alternativas falsas.
Atenção! O teste será em dupla. No entanto, a escolha das duplas será realizada pelo professor. NÃO ADIANTA INSISTIR. Caso algum aluno não aceite o(a) seu(sua) companheiro(a) da dupla, obterá nota ZERO (no teste e no qualitativo). Caso um dos componentes da dupla não compareça na aula, o(a) outro(a) componente fará o teste SOZINHO(A). Como a turma está composta de 37 alunos, haverá apenas um grupo formado de três pessoas (escolhido pelo professor).
BOM ESTUDO!
Nenhum comentário:
Postar um comentário