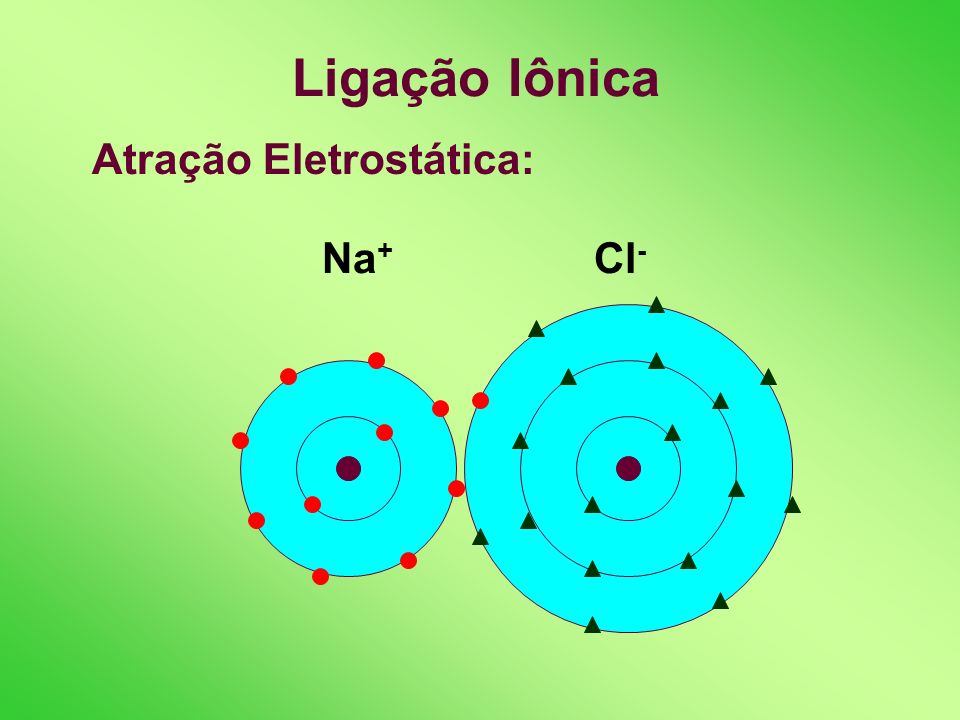
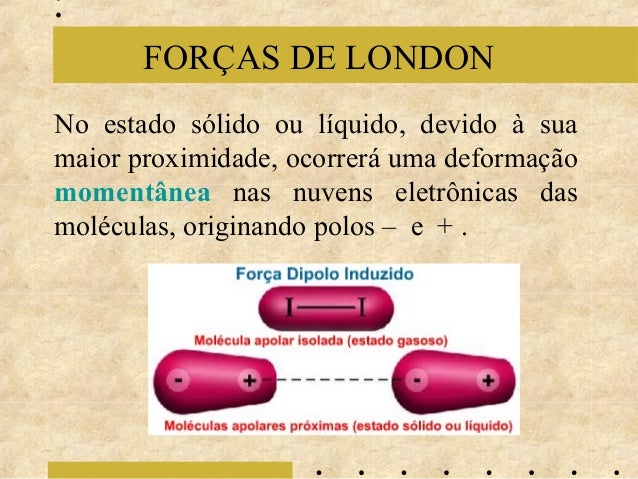
Seguem algumas dicas e informações sobre nossa 1ª avaliação do 2º trimestre (TOTALMENTE DISCURSIVA, ou seja, SEM alternativas):
(5,0)QUESTÃO 1: Excesso de reagente e rendimento de reação. DICA: calcular primeiro aquele que está em excesso; depois, calcular a quantidade de produto que deveria ser (teoricamente) obtido; por último, comparar os resultados teórico e prático, e calcular a % de rendimento.
(5,0)QUESTÃO 2: Estequiometria simples, envolvendo volume e número de moléculas. DICA: 1 mol = 22,4 L (nas CNTP); coeficiente da reação multiplica as informações sobre a moléculas, por exemplo: em 3 H2O tem-se 3 x 6 . 10>(23) moléculas de H2O.
(5,0)QUESTÃO 3: Pureza de reagente. DICA: antes de qualquer cálculo na reação, calcular a quantidade "pura" do reagente para ser colocada na regra de três. Não esqueça: 20 % de impurezas = 80 % de pureza.
(5,0)QUESTÃO 4: Estequiometria fora das CNTP, envolvendo cálculo de volume. DICA: encontrar primeiro o número de mols do gás mencionado para, no final, aplicar na fórmula PV=nRT.
(5,0)QUESTÃO 5: Reações consecutivas (= sucessivas). DICA: conforme já dito em aula, transformar as equações dadas em uma só. Lembrando que: o valor pelo qual você multiplicar uma equação vale para TODOS os compostos; se houver moléculas iguais do mesmo lado, somam-se; se houver moléculas iguais (independente das quantidades) em lados opostos: somam-se as que estiverem do mesmo lado e subtrai-se aquelas do lado oposto.
(10,0)QUESTÃO BÔNUS: Surpresa!
Clique aqui e assista a um playlist de vídeos.
Clique aqui e divirta-se com exercícios!
ABRAÇOS ÀS MINHAS CRIANÇAS ILUMINADAS.

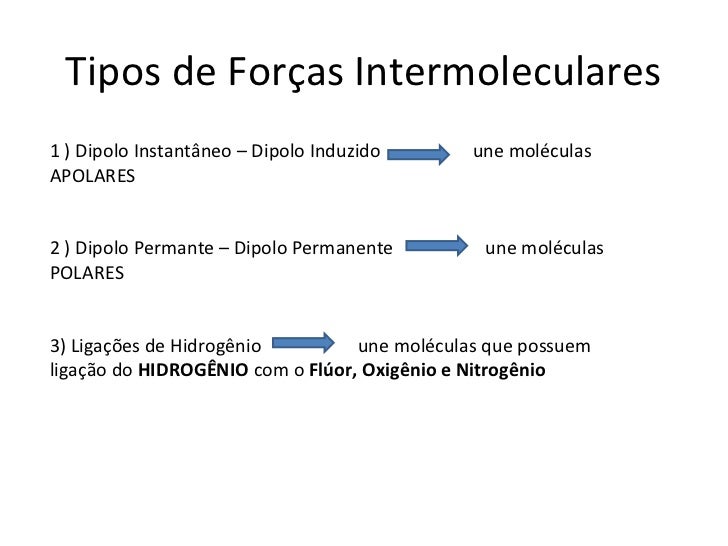

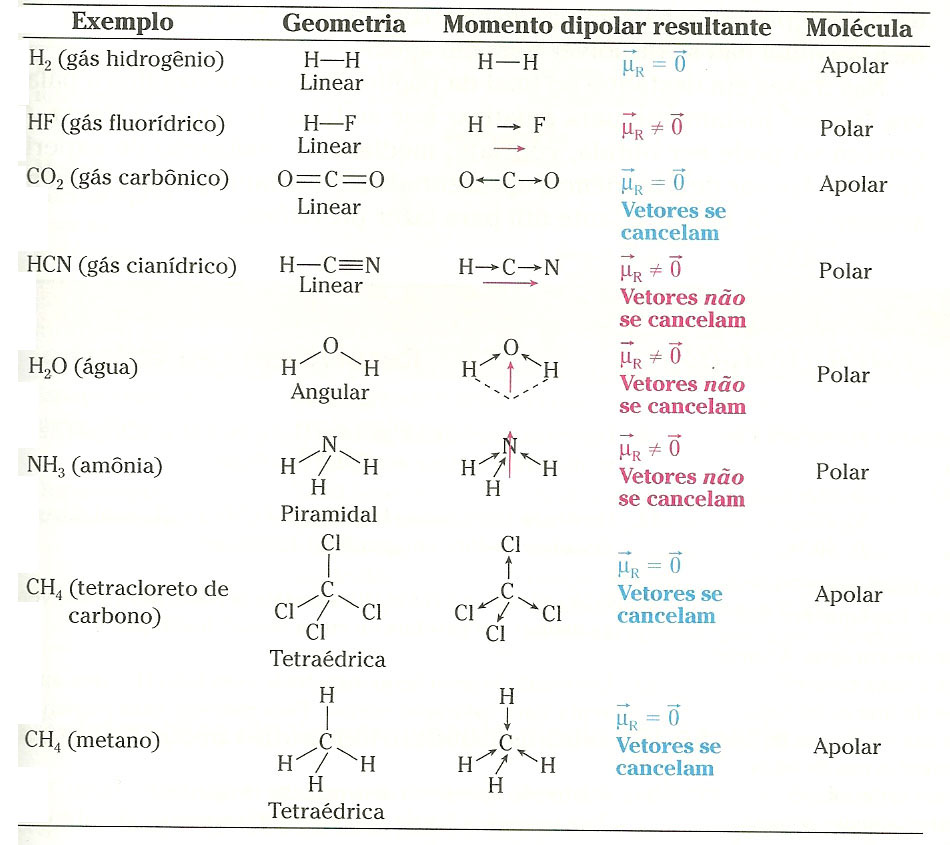








.jpg)